研究背景
对健康结果中个体差异的原因进行研究,已使人们对人类生物学有了变革性的认识,并推动了几乎所有医学分支的发展。历史上,人们一直把研究重点放在遗传因素如何导致人群中的表型变异上。然而,一个新出现的概念——自身反应性抗体(自身抗体)是影响人类健康和疾病的一个关键因素,但在很大程度上尚未得到充分探索。正如先前的遗传学研究一样,研究自身抗体及其在疾病中的保护和病理作用,可能会开启新的治疗模式。
2024年2月15日,美国弗雷德·哈钦森癌症中心的Aaron M. Ring教授联合耶鲁医学院研究人员在Science(IF:56.9)期刊上发表了“Decoding the autoantibody reactome—Autoantibodies influence a wide range of conditions beyond autoimmune diseases”综述论文,系统介绍了自身抗体独特的功能及其广泛的应用前景。
综述内容
抗体由体液免疫系统产生,能够特异性地与几乎任何生物大分子靶标(广义上称为 "抗原")结合(1)。虽然抗体的主要功能是提供针对病原体的适应性免疫,但总会产生一些与自身抗原结合的抗体。这些自身抗体会引起广泛的生物学效应,包括改变其靶标的活性和免疫调节(图1)。每个人都携带一系列不同的自身抗体——"自身抗体反应组",这为性状多样性提供了一条潜在的途径,反映了遗传差异影响表型的方式。
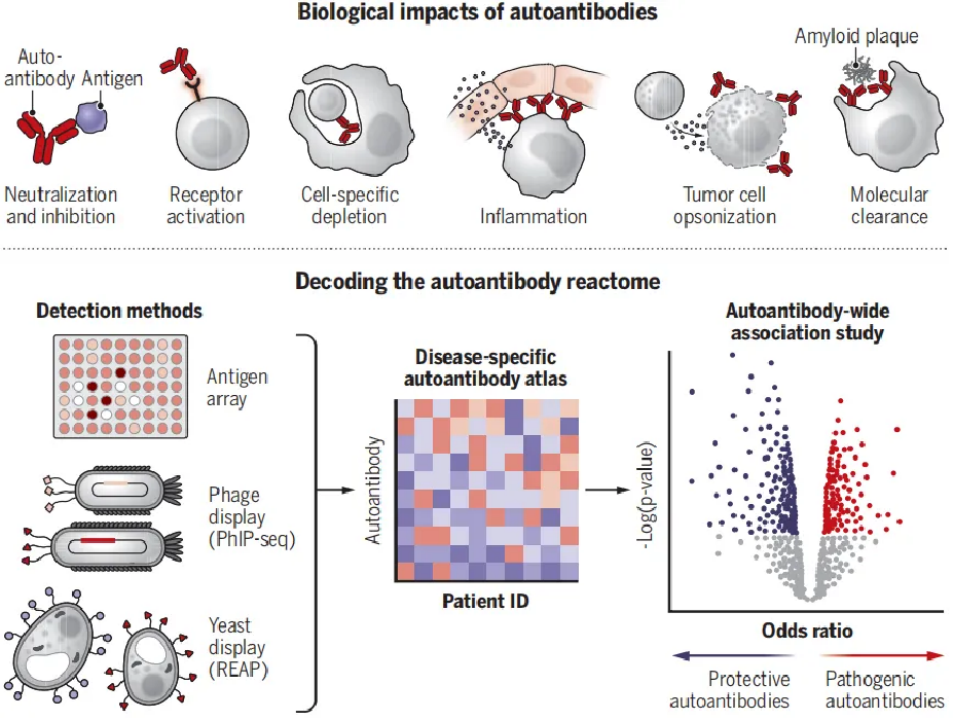
图1 自身抗体对健康和疾病的影响(图注:自身抗体会引起一系列不同的生物效应,导致不同的健康结果,既有致病性临床效应,也有保护性临床效应。类似于全基因组关联研究,抗原微阵列、噬菌体免疫沉淀测序(PhIP-seq)和快速细胞外抗原检测(REAP)等新兴自身抗体发现技术现在可以进行 "全自身抗体关联研究",以确定自身抗体反应组中存在的可能致病的自身抗体。通过这种方法确定的可改变疾病的自身抗体可以阐明新的药物靶点,并为治疗方法的开发提供参考)
自身抗体通常因其在介导自身免疫性疾病中的致病作用而闻名。一般来说,自身抗体几乎可以驱动任何组织发生病理性炎症,主要影响皮肤、关节、肌肉、中枢神经系统以及甲状腺和胰腺等器官(2)。同样,自身抗体也会引发以高度特异性生物效应为特征的独特综合征,类似于孟德尔单基因突变所产生的独特影响,因为它们会干扰体内的重要通路。典型的例子包括重症肌无力,这是一种由抑制乙酰胆碱受体的自身抗体引起的神经肌肉疾病,以及由激活促甲状腺素受体的自身抗体引起的格雷夫斯病中的甲状腺功能亢进。
自身抗体不明显的表型效应受到较少关注,这些抗体可以改变疾病,甚至在临床上无声无息,直到它们的活性在应激状态下被揭示出来。关于这种现象的一个重要例子是在COVID-19大流行期间发现的I型干扰素(IFN-I)中和自身抗体可使COVID-19的死亡风险增加200倍(3)。虽然在大多数情况下IFN-I自身抗体在临床上并无明显症状,但随着年龄的增长,IFN-I自身抗体的流行率会急剧上升,在70岁以上的人群中约占4%(4)。据估计,在所有COVID-19死亡病例中,有 20% 与IFN-I自身抗体的存在有关(4)。这些发现表明,自身抗体既能揭示关键的生物学发现(例如,IFN-I在宿主对严重急性呼吸系统综合征冠状病毒 2(SARS-CoV-2)的免疫中的关键作用),又能在人群中产生深远影响。
然而,自身抗体并不都是有害的,在某些情况下,它们可能会起到改善或预防疾病的保护作用。IFN-I自身抗体再次具有启发性。系统性红斑狼疮(SLE)是一种自身免疫性疾病,50%以上的患者IFN-I信号升高。有趣的是,约5%的系统性红斑狼疮患者体内存在中和IFN-I信号的自身抗体(5)。与COVID-19相反,这些自身抗体与疾病活动性显著降低有关,这可能是通过减弱病理性IFN-I通路功能而实现的(5)。 这一违反直觉的观察结果强调了自身抗体的双面性,表明自身抗体有能力在它们通常被认为是致病因素的疾病中发挥保护作用。
自身抗体的保护作用在许多疾病中都很明显。例如,针对肿瘤相关抗原(TAA)的自身抗体的存在,长期以来一直被认为是多种癌症患者的一个良好的预后因素。多项研究表明,TAA反应性自身抗体(如各种上皮癌中的抗黏蛋白 1(MUC1)和乳腺癌中的抗人表皮生长因子受体 2(HER2))与患者更好的生存率和复发率有关(6, 7)。据推测,这些自身抗体可引起免疫导向的肿瘤细胞杀伤,从而改善肿瘤控制。在其他情况下,确定肿瘤反应性自身抗体的特异性分子靶点导致鉴定出新的 TAAs,包括 NY-ESO、MAGE、BAGE、GAGE 和 HOM-MEL-40(8)。因此,癌症自身抗体为支持免疫系统在肿瘤监测中的作用提供了重要证据,并揭示了以前未发现的癌症治疗靶点。自身抗体可能对肿瘤有其他作用,如调节治疗反应,但还需要进一步的研究。
神经退行性疾病中的自身抗体是有益自身反应的另一个例子。识别淀粉样蛋白肽(淀粉样蛋白-β的短片段,容易形成与神经变性有关的斑块)的自身抗体存在于健康人体内,并随着年龄的增长而减少,尤其是在阿尔茨海默氏症(AD)患者中(9)。这一观察结果表明,这种抗体可以保护人们免受阿尔茨海默病的侵害,并能带来治疗效果。在这些发现的基础上,针对淀粉样蛋白-β多肽的单克隆抗体被开发出来,并在临床前AD模型和AD患者的临床试验中被发现能促进大脑内斑块的清除并减缓认知能力的下降(10)。事实上,美国食品和药物管理局(FDA)最近批准的一种淀粉样蛋白-β抗体--阿杜单抗(aducanumab),就是从一组没有认知功能退化迹象或认知功能异常逐渐下降的老年人体内获得的自身抗体中开发出来的(10)。这表明,自身抗体不仅提供了潜在的治疗范例,而且在某些情况下,自身抗体本身也可以作为治疗药物加以推广。
总的来说,自身抗体与健康结果之间的关联可以提供重要信息,说明应该用什么药(什么基因产物)以及何时用药(哪种疾病适应症)。例如,在系统性红斑狼疮中,保护性的IFN-I阻断自身抗体似乎模仿了阿尼鲁单抗(一种用于治疗系统性红斑狼疮的单克隆抗体,靶向IFN-I受体IFNAR1)的治疗效果,而乳腺癌中的HER2自身抗体则反映了曲妥珠单抗(一种用于治疗HER2阳性恶性肿瘤的HER2单克隆抗体)的药理作用(5、6)。然而,潜在的治疗靶点不仅可以从保护性自身抗体(治疗应模仿这些抗体)中找到,还可以从有害的自身抗体中找到。有害的自身抗体会突显一些通路,这些通路的功能不受干扰是实现最佳健康结果所必需的,这意味着理想的治疗药物会产生相反的效果。例如,虽然中和IFN-I的自身抗体会加重COVID-19的严重程度,但服用与IFN-I具有相似生物特性的重组III型干扰素有望成为COVID-19的治疗药物(11)。
值得注意的是,自身抗体的功能可为如何对特定目标用药(何种药理作用机制)提供信息。自身抗体可被视为天然生物药物,对人体生理具有一系列非同寻常的潜在影响。例如,直接激活或抑制信号受体,稳定配体并延长其循环半衰期,或促进其清除(2)。此外,自身抗体还能通过与免疫效应细胞上表达的 Fc 受体相互作用来发挥免疫调节功能,从而驱动抗体依赖细胞介导的细胞毒性作用(ADCC)、吞噬作用(ADCP)或补体介导的杀伤作用(CDC),消耗其表面表达靶抗原的细胞(1)。因此,将自身抗体与临床关联的知识与对自身抗体功能的理解结合,就能提出全面的治疗假设,从而将药物靶点与特定的治疗适应症和潜在的作用机制联系起来。
虽然自身抗体可以发挥巨大的临床作用,并为治疗方法的开发提供启示,但它们对生理学的影响可能被低估了。这很可能是因为没有进行过全面调查,以确定自身抗体在整个人类蛋白质组范围内的普遍程度。这一挑战的核心是缺乏无偏倚、高通量检测自身抗体的实验工具。因此,改变疾病的自身抗体在很大程度上是通过以已知生物学为依据的假设驱动法,或通过通量和可扩展性有限的具有挑战性的实验技术发现的。然而,下一代自身抗体检测方法的出现是一个实质性的突破,可对不同人群的人体自身抗体进行深入和高通量研究。
全面检测自身抗体的开创性工作受到了基因组技术进步的启发。在 DNA 阵列取得成功的基础上,自身抗原微阵列实现了高度多重的自身抗体检测,能够筛查数千种抗原(12)。下一代测序(NGS)技术的出现促进了噬菌体免疫沉淀测序(PhIP-seq)等新方法的研发,该方法使用基因编码的噬菌体展示文库来展示长度约为 50 个氨基酸的各种肽 "Tiles"(13)。这些自繁殖噬菌体文库可用于筛选与患者样本中存在的自身抗体的结合,从而有效地将自身抗体-抗原结合转化为具有蛋白质组深度的高通量测序读数。然而,PhIP-seq 和相关的肽展示技术并不能捕获正确折叠的 "构象 "抗原,而这些抗原正是许多自身抗体的靶标。为弥补这一缺陷,人们开发了其他技术。其中一个例子是快速细胞外抗原分析(REAP),它与 PhIPseq 类似,但利用了酿酒酵母表达和显示细胞外和分泌蛋白全长外结构域的能力(14)。归根结底,目前还没有一种技术能对所有自身抗原进行采样,但总的来说,它们能检测到自身抗体反应组的很大一部分。
PhIP-seq和REAP已被用于共同揭示众多疾病适应症和健康人的数千种自身反应。正如对人类基因组进行测序以注释整个基因组的突变一样,类似的原理也可能适用于人类蛋白质组和自身抗体: 对于每一种蛋白质,都可能存在具有影响该蛋白质活性和/或行为的功能性自身抗体的个体。随着高度可扩展的自身抗体检测技术的出现,现在可以用DNA测序技术进行全基因组关联研究的方式来进行“全自身抗体关联研究”。这些工作有望精确定位对健康有潜在因果影响的自身抗体,从根本上解码 "自然临床试验",从而确定对疾病产生有意义影响的内源性药物(自身抗体)。
要实现全自身抗体关联研究,就必须应对自身抗体生物学固有的挑战。一个主要挑战是自身抗体本身的多样性。虽然已观察到成千上万种不同的自身抗体类别,但在 PhIP-seq 和 REAP 数据集中看到的单个自身反应通常很少见,通常只出现在<1%的人群中(15)。因此,要获得检测显著的自身抗体临床关联的统计能力,可能需要每个适应症有数千名患者的大型队列。另一个挑战是自身抗体的动态变化。自身抗体不会贯穿个体的整个生命周期,一般在成年后才会出现。纵向研究显示,某些自身抗体反应可持续数年,如在系统性红斑狼疮患者中观察到的IFN-I自身抗体(5)。与此相反,其他自身抗体反应则是短暂的,如在SARS-CoV-2感染过程中出现的一些自身反应性抗体,其消退时间仅为数周(15)。因此,自身抗体在时间上的差异给确定其与疾病的因果关系带来了复杂性。此外,自身抗体反应通常由抗体谱系的多克隆混合物组成,这些抗体谱系可能随着时间的推移而具有不同的功能(2)。由于抗体类型、亚类和翻译后Fc修饰的变化,自身抗体的效应功能也会发生动态变化(1)。
这些挑战也为未来了解自身抗体的独特性能及其广泛功能的研究提供了不可忽视的机遇。最终,不断发展的自身抗体研究有望为生物医学创新开辟新的视野,使从我们自身免疫系统中获得灵感的发现成为可能。
原文链接:https://www.science.org/doi/10.1126/science.abn1034
参考文献
1. K. Murphy, C. Weaver, Janeway’s Immunobiology (Garland Science/Taylor & Francis Group, ed. 9, 2016).
2. R.J. Ludwig et al., Front. Immunol. 8, 603 (2017).
3. P. Bastard et al., Science 370, eabd4585 (2020).
4. P. Bastard et al., Sci. Immunol. 6, eabl4340 (2021).
5. H. F. Bradford et al., Cell Rep. Med. 4, 100894 (2023).
6. M. L. Disis et al., J. Clin. Oncol. 15, 3363 (1997).
7. Y. Kotera, J. D. Fontenot, G. Pecher, R. S. Metzgar, O. J. Finn, Cancer Res. 54, 2856 (1994).
8. Y. T. Chen et al., Proc. Natl. Acad. Sci. U.S.A. 94, 1914 (1997).
9. M. Britschgi et al., Proc. Natl. Acad. Sci. U.S.A. 106, 12145 (2009).
10. J. Sevigny et al., Nature 537, 50 (2016).
11. G. Reis et al., N. Engl.J. Med. 388, 518 (2023).
12. W. H. Robinson et al., Nat. Med. 8, 295 (2002).
13. H. B. Larman et al., Nat. Biotechnol. 29, 535 (2011).
14. E. Y. Wang et al., Cell Rep. Methods 2, 100172 (2022).
15. E. Y. Wang et al., Nature 595, 283 (2021).